Autor: Dr. Samira Schroeder
Bindung von Keimen und MMPs reduziert Infektionsrisiko
Einleitung
Die Haut ist flächenmäßig das größte Organ des menschlichen Körpers. Sie ist die entscheidende Komponente, die das innere Gewebe vor mechanischer Beschädigung, ultravioletter Strahlung, extremer Temperatur und mikrobieller Infektion abschirmt (vgl. Rodrigues et al. 2019). Während die Haut im gesunden Zustand mit einer individuellen vor pathogenen Mikroorgansimen schützenden Mikroflora versehen ist, unterbrechen Wunden diesen Schutz lokal für eine gewisse Zeit. Die Mikroflora der Wunde gerät in diesem Fall aus dem Gleichgewicht, und viele weitere Variablen beeinflussen Physiologie und Heilungsprozess der Wunde. In akuten Wunden findet über Entzündungs-, Reparatur- und Umbauphase ein geregelter Heilungsprozess statt. Die Entzündungsphase in Wunden ist durch die Anwesenheit von Granulozyten und Makrophagen charakterisiert. Sie haben die Aufgabe, Bakterien und andere Fremdkörper zu inaktivieren und setzen dazu z. B. Sauerstoffradikale ab, auf die Mikroorganismen empfindlich reagieren, sowie Zytokine und Proteasen, die den Entzündungsprozess aufrechterhalten. Proteasen, insbesondere Matrix-Metalloproteasen (MMPs), nehmen im normalen Wundheilungsprozess eine Schlüsselrolle ein. MMPs sind Enzyme, welche Proteine, wie z. B. die der extrazellulären Matrix (EZM) und Bindegewebsproteine aufspalten können. Im normalen Wundheilungsprozess spalten MMPs beschädigte EZM-Proteine und Fremdmaterial auf, damit sich daraus neues Gewebe bilden und der Wundverschluss in einer geordneten Weise ablaufen kann. Im Unterschied zu akuten Wunden, die nach der Entzündungsphase in diese Reparaturphase übergehen, verharren chronische Wunden in der Entzündungsphase und bleiben oft über Monate oder sogar Jahre in diesem Zustand (vgl. Calne 2011).
Ungleichgewicht in chronischen Wunden
Mehrere Studien haben gezeigt, dass das Wundexsudat nicht heilender Wunden erhöhte Konzentrationen von MMPs und Elastase der polymorphkernigen Granulozyten (PMN) enthalten (vgl. Trengove et al. 1999; Yager & Nwomeh 1999). Die übermäßige Wirkung der Elastase führt zu erheblich reduzierten Mengen an Wachstumsfaktoren (vgl. He et al. 1999) und endogenen MMP-Inhibitoren wie die ‚tissue inhibitors of matrix-metalloproteases‘ (TIMPs). So können im Übermaß vorhandene MMPs Kollagen, Elastin und Fibronektin ungebremst spalten, was zu einer anhaltenden Zerstörung der extrazellulären Matrix führt (vgl. Yager et al. 1997). Außerdem wird die Freisetzung von proinflammatorischen Zytokinen durch Makrophagen und Granulozyten deutlich erhöht (vgl. Harris et al. 1995), und verglichen mit der akuten Wunde sind die Konzentrationen von reaktiven Sauerstoff- und Stickstoffverbindungen (ROS/RNS) in chronischen Wunden deutlich erhöht (vgl. James et al. 2003). Ein andauernder Entzündungszustand kann zu sichtbaren Infektionszeichen führen, die u. a. durch die Permeabilisierung der Blutbahnen im Bereich der Entzündung und das Einströmen von Flüssigkeit und weiteren Immunzellen in den Bereich der Wunde ausgelöst werden.
Polyurethan-Schaumverbände können zur effektiven Bindung von MMP beitragen
Um die MMP-Aktivität wieder in Richtung eines physiologischen Zustands zu bringen, können das Wundbett optimiert (Reinigung, Debridement etc.), die Bakterienlast reduziert und/oder protease-modulierende bzw. -bindende Wundauflagen verwendet werden. So können z. B. saugfähige Wundauflagen durch die Entfernung proteasehaltiger Wundflüssigkeit die Proteaseaktivität reduzieren (vgl. Calne 2011). Eine in vitro-Studie von Braunwarth et al. (2020) hat gezeigt, dass Polyurethan (PU)-Schaumverbände zur zuverlässigen und dauerhaften Bindung von MMP geeignet sein können. Mittels Enzyme-linked Immunosorbent Assay (ELISA) hat z. B. Biatain® Silicone in dieser Studie eine dauerhafte MMP-Bindekapazität von mehr als 90% gezeigt.
Eine Reduktion der Bakterienlast reduziert das Risiko einer Infektion
Die Wundinfektion ist eine der Hauptfaktoren, die zur Verlängerung der Wundheilungsdauer beitragen (vgl. Warriner & Burrell 2005). Eine erhöhte Bakterienlast in Wunden verstärkt ein proinflammatorisches Milieu und das Risiko einer Wundinfektion. Daher wurde postuliert, dass es zur Verbesserung der Wundheilungschancen notwendig ist, Bedingungen zu schaffen, die für Mikroorganismen ungünstig und für die Reparaturmechanismen des Wirts günstig sind (vgl. Percival 2005). Daher werden bei infizierten Wunden topische antimikrobielle Wirkstoffe, wie z. B. silberbasierte Wundauflagen, verwendet, um die Wunde auf die Heilung vorzubereiten. Silber (Ag) ist in geeigneter Konzentration wirksam gegen ein breites Spektrum von Mikroorganismen wie Hefe, Schimmelpilze und Bakterien, einschließlich Methicillin-resistenter Staphylococcus aureus (MRSA) und Vancomycin-resistente-Enterokokken (VRE) (vgl. Percival 2005; Burrell 2003). In Abwesenheit einer etablierten Infektion und eher geringer bakteriellen Belastung kommen jedoch bevorzugt Verbandmittel mit passiver Keimelimination, also ohne aktive Komponente zum Einsatz (vgl. Braunwarth & Brill 2014).
Mehr als 99% Bakterienbindungskapazität mittels PU-Schaumverband
Um bei solchen Wunden einen guten Heilungserfolg zu erzielen, werden sie bevorzugt mit modernen Verbänden wie PU-Schaumverbänden behandelt. Diese sind saugfähig, wasserdampfdurchlässig und in der Lage, Wundbakterien im Schaumverband zu binden (vgl. Braunwarth 2020). Eine in vitro-Studie gibt konkretere Auskunft über die Bakterienbindungskapazität (BBK) solcher PU-Schaumverbände (vgl. Braunwarth & Friedmann 2020).
Methode
Testproben (Biatain® Silicone im Vergleich zu Gaze; Biatain Silicone besteht aus drei Schichten: Silikon, PU-Schaum und Superabsorber) wurden mit künstlicher, mit Pseudomonas aeruginosa beimpften, Wundflüssigkeit in Kontakt gebracht und nach einer Inkubationszeit von jeweils einer bzw. 24 Stunden einer Druckbelastung von jeweils 40 mmHg bzw. 200 mmHg ausgesetzt, wie sie auch ein Sekundärverband ausüben kann. Anschließend wurde die Restmenge der im Verbandmaterial verbliebenen Bakterien in Relation zu der durch den Druck herausgepressten Bakterienmenge gesetzt und die BBK ermitteltet.
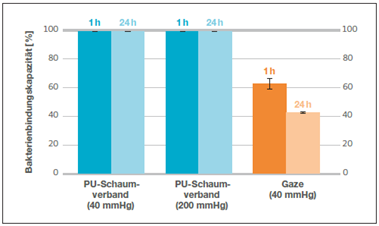
Ergebnis: PU-Schaumverband konnte 99% der Bakterien stabil im Verband binden
Für den PU-Schaumverband ergab sich eine BBK von 99,98%, nachdem er nach einer Inkubationszeit von einer Stunde einem Druck von 40 mmHg ausgesetzt worden war – 99,98% der Bakterien verblieben also im Verband (Abb. 1). Der entsprechende Wert für Gaze lag bei 63%. Selbst nachdem in einem weiteren Versuch der PU-Schaumverband einem Druck von 200 mmHg ausgesetzt worden war, betrug seine BBK 99,86%. Auch nach einer 24-stündigen Inkubationszeit betrug die BBK für beide Druckbelastungen beim PU-Schaumverband noch annähernd 100%. Der entsprechende Wert für Gaze lag bei 43%.
Zudem wurde die Bakterienverteilung auf den verschiedenen Materialien des PU-Schaumverbands mit einem Rasterelektronenmikroskop (REM) betrachtet (Abb. 2). Dabei ergab sich kein mikroskopisch erkennbarer Einfluss eines Drucks von 40 mmHg auf die Bakterienbindung oder ihre Verteilung zwischen den Materialien.

Zusammengefasst zeigt diese in vitro-Untersuchung, dass der PU-Schaumverband auch unter Druckbelastung und verschiedenen Inkubationszeiten mehr als 99% der Bakterienmenge stabil im Verband bindet.
Fazit
Eine Reduzierung der MMP in der Wunde Richtung physiologischem Milieu sowie die Reduktion der Bakterienlast verringern das Wund-Infektionsrisiko deutlich. So verbessern sich zudem die Wundheilungschancen signifikant. Wissenschaftliche Studien konnten in vitro eine effektive MMP- und Bakterienbindung in bestimmtem PU-Schaumverbänden belegen. Für die Praxis sind sich Experten weltweit einig, dass zur Reduktion von Infektionsrisiken auch ein Kontakt zum Wundgrund hergestellt werden sollte. So kann effektiv MMP und Bakterien enthaltendes Wundexsudat durch PU-Schaumverbände aufgenommen und effektiv gebunden, sowie gleichzeitig die Wunde feucht gehalten werden.
Der Artikel wurde mit freundlicher Unterstützung der Firma Coloplast erstellt.
Literatur - Braunwarth, H. (2020): Hervorragende Keimbindung auch unter Druck. WUNDmanagement, 15. Jahrgang, Supplement 1. Braunwarth, H. und Brill, FHH. (2014): Antimicrobial Efficacy of Modern Wound Dressings: Oligodynamic Bactericidal versus Hydrophobic Adsorption effect. Wound Medicine 5: 16–20. - Braunwarth, H. und Friedmann, A. (2020): Characterization of bacteria binding capacity of polyurethane foam dressing under compressive stress. Veröffentlichung am EWMA 2020, 18.–19. November, https://ewma.org/ewma- conferences/2020/scientific. - Braunwarth, H.; Friedmann, A. und Petzold, W. (2020): Investigation of the influence of PU wound dressings (Biatain®) on the proteolytic activity of proteases present in the wound exudate; in vitro. Unveröffentlichte Studie. - Burrell, RE. (2003): A scientific perspective on the use of topical silver preparations. Ostomy Wound Manage 49 (5A Suppl.): 19–24. - Calne, S. (2011): International consensus. The role of proteases in wound diagnostics. An expert working group review. London: Wounds International. - Harris, IR.; Yee, CE.; Walters, CE.; Cunliffe, WJ.; Kearney, JN.; Wood, EJ. and Ingham, E. (1995): Cytokine and protease levels in healing and non-healing chronic venous leg ulcers. Exp Dermatol 4: 342–9. - He, C.; Hughes, MA.; Cherry, GW. and Arnold, F. (1999): Effects of chronic wound fluid on the bioactivity of platelet-derived growth factor in serum-free medium and its direct effect on fibroblast growth. Wound Repair Regen 7: 97–105. - James, TJ.; Hughes, MA.; Cherry, GW. and Taylor, PT. (2003): Evidence of oxidative stress in chronic venous ulcers. Wound Repair Regen 11: 172–6. - Keast, DH.; Bain, K.; Hoffmann, C; Swanson, T.; Dowsett, C.; Lázaro-Martínez, JL; Karlsmark, T; Münter, KC.; Ruettimann Liberato de Moura, M.; Brennan, MR.; Vuagnat, H.; Greco, A.; Bing, W. and Bain, M. (2020): Managing the gap to promote healing in chronic wounds — an international consensus. Wounds International, Vol 11; Issue 3. - Percival, SL.; Bowler, PG. and Russel, D. (2005): Bacterial resistance to silver in wound care. J Hosp Infect 60: 1–7. - Rodrigues, M.; Kosaric, N.; Bonham, CA. and Gurtner, GC. (2019): WOUND HEALING: A CELLULAR PERSPECTIVE. Physiol Rev 99: 665–706. - Trengove, NJ.; Stacey, MC.; Macauley, S.; Bennett, N.; Gibson, J.; Burslem, F.; Murphy, G. and Schultz, G. (1999): Analysis of the acute and chronic wound environments: the role of proteases and their inhibitors. Wound Repair Regen 7: 442–52. - Warriner, R. and Burrell, R. (2005): Infection and the chronic wound: a focus on silver. Adv Skin Wound Care 18 (Suppl. 1): 2–12. - Yager, DR. and Nwomeh, BC. (1999): The proteolytic environment of the chronic wounds. Wound Repair Regen 7: 433–41. - Yager, DR.; Chen, SM.; Ward, SI.; Olutoye, OO.; Diegelmann, RF. and Cohen, K. (1997): Ability of chronic wound fluids to degrade peptide growth factors is associated with increased levels of elastase activity and diminished levels of proteinase inhibitors. Wound Repair Regen 5: 23–32.
